Siga o Olhar Digital no Google Discover
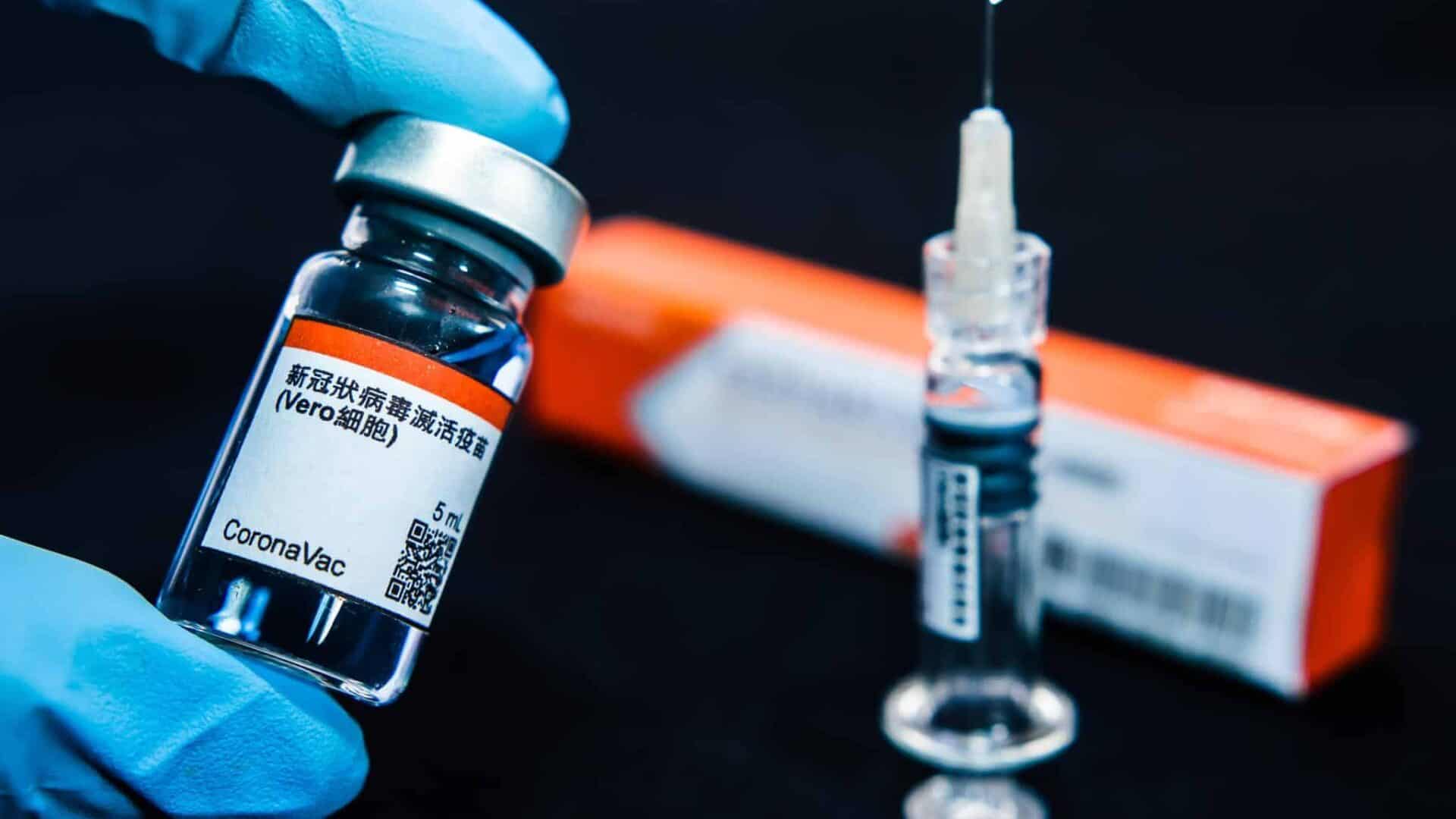
A Agência Nacional de Vigilância Sanitária (Anvisa) anunciou nesta segunda-feira (9) a paralisação dos testes da vacina CoronaVac, desenvolvida pelo laboratório Sinovac com uma parceria com o Instituto Butantan em São Paulo. A interrupção se deve a um “evento adverso grave” não revelado.
Ofertas

Por: R$ 36,21

Por: R$ 24,96

Por: R$ 9,90

Por: R$ 5,86





Por: R$ 113,70

Por: R$ 6,90


Por: R$ 37,92

Por: R$ 22,59

Por: R$ 59,95

Por: R$ 3.099,00

Por: R$ 3.324,00

Por: R$ 799,00

Por: R$ 241,44
Por: R$ 388,78

Por: R$ 2.159,00

Por: R$ 188,99

Por: R$ 45,00

Por: R$ 379,00

Por: R$ 1.239,90

Por: R$ 943,20

Por: R$ 798,99

Por: R$ 199,00

Por: R$ 476,10

Por: R$ 1.139,05

Por: R$ 949,00


Por: R$ 119,90

Por: R$ 398,99

Por: R$ 79,90

Por: R$ 199,90
Segundo a agência, o caso foi registrado no dia 29 de outubro. A interrupção visa analisar os riscos e benefícios de prosseguir com a vacina e investigar se a ocorrência teve a ver com a aplicação da CoronaVac.
A Anvisa define como “evento adverso grave”:
- óbito;
- evento adverso potencialmente fatal (aquele que, na opinião do notificante, coloca o indivíduo sob risco imediato de morte devido ao evento adverso ocorrido);
- incapacidade/invalidez persistente ou significativa;
- exige internação hospitalar do paciente ou prolonga internação;
- anomalia congênita ou defeito de nascimento;
- qualquer suspeita de transmissão de agente infeccioso por meio de um dispositivo médico ou;
- evento clinicamente significante.
Enquanto os estudos estão paralisados, novos voluntários não podem ser recrutados ou vacinados. A agência diz que os dados deverão ser mantidos sob sigilo por respeito ao voluntário afetado.
A suspensão de testes de vacinas tem sido um fato recorrente nos últimos tempos, e é de esperar que seja assim. Ensaios clínicos têm regras rígidas que exigem a paralisação a qualquer sinal de risco aos participantes, mesmo que a vacina não tenha causado o evento considerado grave.
O primeiro caso do tipo nas pesquisas contra a Covid-19 foi o da vacina desenvolvida pela farmacêutica AstraZeneca com a Universidade de Oxford, registrado em setembro, quando um participante no Reino Unido desenvolveu uma mielite transversa, uma inflamação na espinha que pode ser grave e causada por condições autoimunes. Após a conclusão da investigação, as autoridades definiram que era seguro dar prosseguimento aos testes no mundo inteiro em apenas alguns dias.
A Johnson & Johnson foi outra empresa a registrar um evento adverso grave entre seus voluntários, que forçou a interrupção dos testes. A ocorrência se deu em 13 de outubro, e a retomada dos testes no Brasil só foi liberada após 3 de novembro.
Em nenhum dos casos anteriores foi constatado que o evento foi causado pela aplicação da vacina, o que deu aos pesquisadores a segurança de retomar os experimentos.